
胰腺癌的发病率在世界范围内呈持续上升态势。中国国家癌症中心 2017 年统计数据显示,胰腺癌居我国男性恶性肿瘤发病率的第 7 位,女性第 11 位,占恶性肿瘤相关死亡率的第 6 位。
作为预后极差的消化系统肿瘤,胰腺癌具有早期诊断困难、手术切除率低、术后易复发转移等临床特点,临床诊治极具挑战性。中华医学会外科学分会胰腺外科学组对《胰腺癌诊治指南(2014)》进行修订,针对胰腺癌诊断、外科治疗、局部进展期胰腺癌的转化治疗等若干热点问题,评述现状与进展,结合文献及临床经验提出 40 项指导性建议,进行 2021 胰腺癌诊治指南编写。
本指南依据 GRADE 系统进行证据质量评估及推荐强度分级,证据等级分为高、中、低三级,推荐强度分为强烈推荐和一般性推荐。本指南仅适用于胰腺导管上皮来源的恶性肿瘤,即胰腺癌。
建议在较大规模的中心经 MDT 多学科团队讨论进行胰腺癌的综合诊治,多学科团队应由外科、影像科、内镜科、病理科、肿瘤内科、介入科、放疗科等专业的医师参与,并贯穿患者诊治的全部过程。根据患者的基础健康状况、临床症状、肿瘤分期及病理学类型,共同制定个体化诊疗计划,使患者达到最佳的治疗效果。
一、胰腺癌的诊断
(一)临床表现及高危因素

临床表现:
根据肿瘤部位和大小、受累器官及其严重程度不同可表现为:上腹或背部疼痛、恶心、腹胀、黄疸、新发糖尿病、体重减轻及大便性状改变等;偶有以急性胰腺炎为主要表现者;上述症状均无特异性,部分无任何症状,为体检时偶然发现胰腺占位。
与发病相关危险因素:肥胖、2 型糖尿病及吸烟等。
* 据我国大数据统计,近 5 年国内较大规模胰腺中心经手术切除的 10000 余例胰腺癌患者中,华东地区占比最高,男性近 60%,60~74 岁占 53%,吸烟史者占 27%,酗酒史者占 17%。有家族遗传者仅占 1%,低于国外文献报告。
5%~10% 的胰腺癌患者具有遗传易感因素(如图)
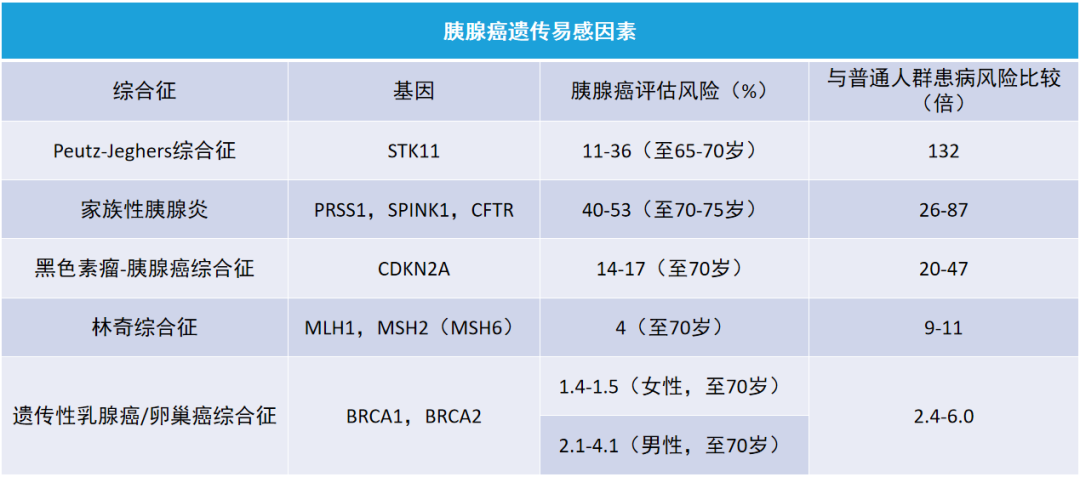
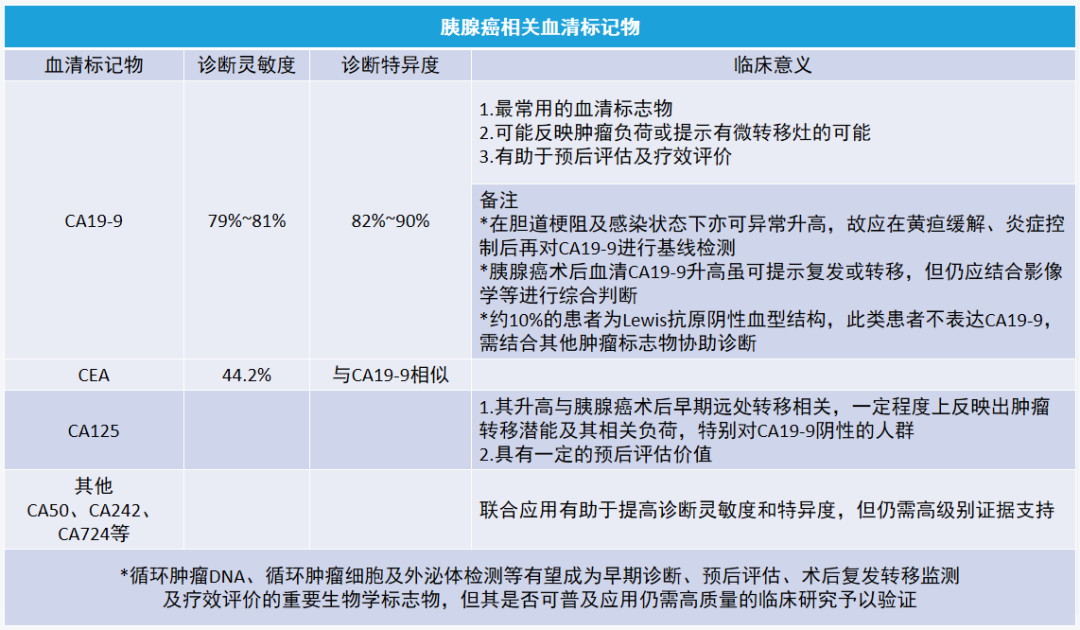
(二)血清肿瘤标志物在胰腺癌诊断及疗效评估中的意义

(三) 影像学技术在胰腺癌诊治中的应用

* 影像学检查是临床诊断胰腺癌的最重要方式,其在胰腺癌术前分期和可切除性评估、新辅助治疗或转化治疗后效果评价、治疗后的监测及随访等方面均具有重要价值。
* 对于拟行胆管支架置入减黄的患者,建议在支架置入前完成影像学检查,以免支架对病灶及其周围解剖结构的影像产生干扰。
常用的影像学检查方法:多期增强 CT、动态增强 MRI。

(四)内镜超声(endoscopic ultrasonography,EUS)在胰腺癌术前诊断中的应用


(五)三维可视化技术在胰腺癌诊治中的应用


二、胰腺癌的分期与可切除性评估

胰腺癌分期如图。
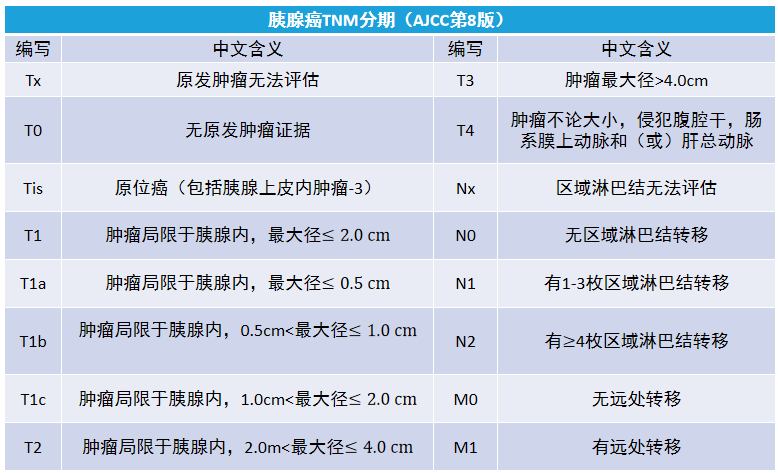
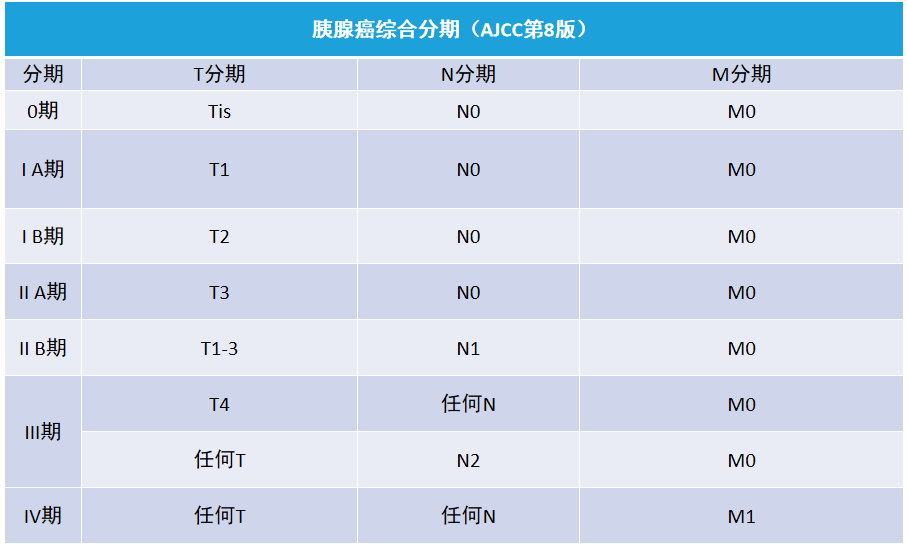
基于影像学检查结果提示的肿瘤与其周围重要血管的关系及远处转移情况,评估肿瘤的可切除性,并将其分为可切除、交界可切除和不可切除三种类型如图。


三、新辅助治疗在胰腺癌治疗中的应用
(一)新辅助治疗在可切除胰腺癌中的应用

目前国内外指南多提倡针对病理诊断明确且合并高危因素的可切除胰腺癌患者开展新辅助治疗。
已知高危因素:CA19-9 显著增高、瘤体较大、区域淋巴结肿大疑似转移、体重显著降低和伴有明显疼痛等。
针对合并上述高危因素的可切除胰腺癌患者,经 MDT 讨论并综合评估患者意愿、体能状态及实际情况后可开展新辅助治疗。目前针对可切除胰腺癌的上述高危因素,尚缺乏一致的量化标准,建议开展相关临床研究。

(二)新辅助治疗在交界可切除胰腺癌中的应用


(三)胰腺癌新辅助治疗效果评价

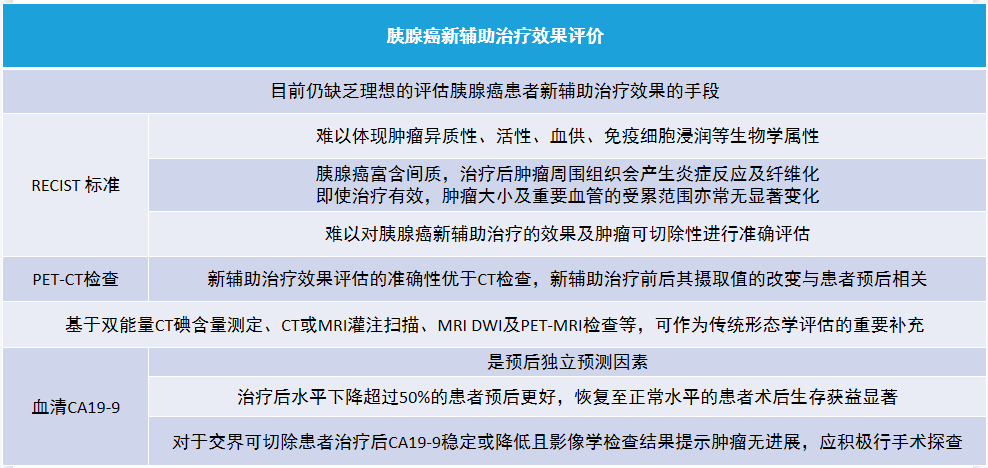
(四)胰腺癌新辅助治疗后的病理学评估

有研究结果表明,病理学评估为完全反应或接近完全反应者的预后好于肿瘤广泛残存的患者。
以美国病理学会根据 Ryan 结直肠癌评价方案改良的四级评分系统最为常用(如图)。
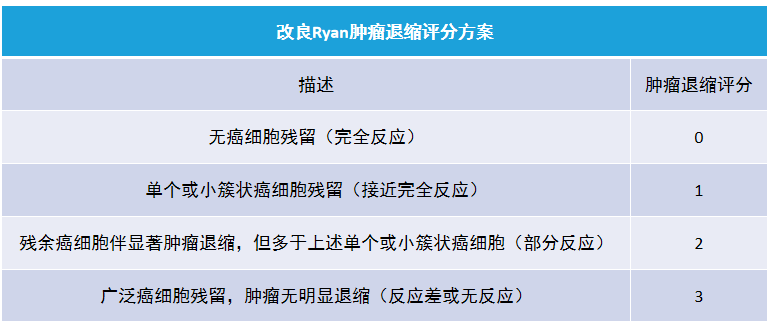
鉴于胰腺癌富含间质及新辅助治疗后的促纤维化作用,新辅助治疗后根据肿瘤大小的变化不足以准确提示治疗效果,应结合镜下残存肿瘤细胞数目综合评价。
注意:1. 建议通过大切片全景评估新辅助治疗后的切除标本,以客观评价治疗效果;2. 需充分取材,准确评估残余肿瘤细胞数量。
四、胰腺癌的外科治疗
(一)胰腺癌患者术前营养评估与营养支持

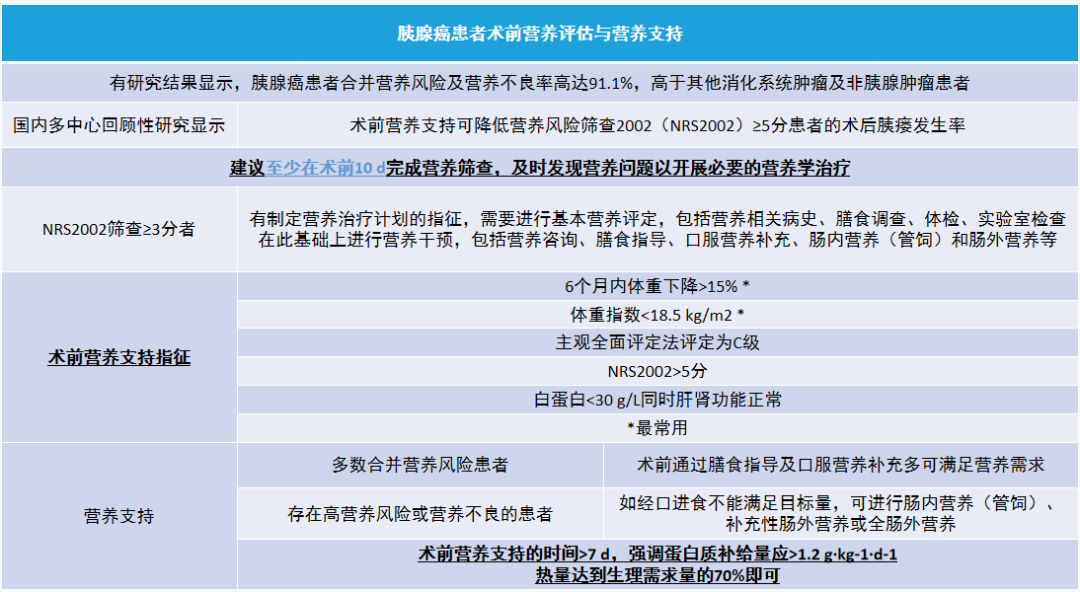
(二)术前胆道引流(preoperative biliary drainage,PBD)


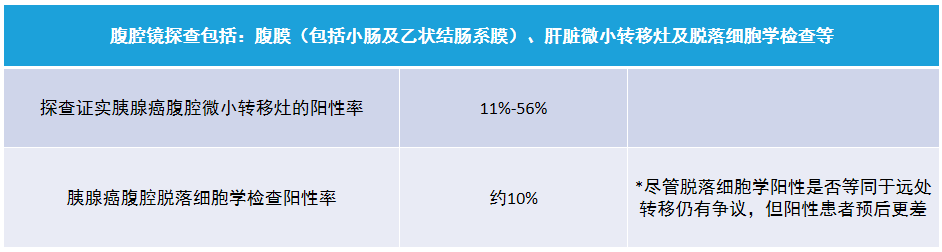
(三)术前腹腔镜探查在胰腺癌诊治中的应用


对于无高危因素的可切除胰腺癌患者是否术前常规行腹腔镜探查仍有争议,可在综合评价后选择性应用。
(四)腹腔镜及机器人辅助手术在胰腺癌外科治疗中的应用

腹腔镜和机器人辅助手术应用于胰腺癌的外科治疗仍然存在较大争议,主要体现在治疗效果的肿瘤学评价及手术安全性等方面
(五)根治性顺行模块化胰脾切除术(radical antegrade modular pancreatosplenectomy,RAMPS)在胰体尾癌治疗中的应用

胰体尾脾切除术是治疗胰体尾癌的标准术式,标准范围的淋巴结清扫需包括脾动脉周围、胰腺下缘及脾门淋巴结,扩大范围者还应包括肝总动脉、腹腔干和部分肠系膜上动脉左侧淋巴结。
2003 年 Strasberg 将 RAMPS 应用于胰体尾癌患者,根据是否联合左肾上腺切除分为前 RAMPS 及后 RAMPS,其内涵是对腹膜后切除平面的扩展,强调腹膜后切缘 R0 切除及对血管根部淋巴结的清扫。
尽管 RAMPS 对胰腺癌远期预后的改善作用仍存在争议,但因其理论上的合理性及围手术期的安全性,有助于提高胰体尾癌 R0 切除率,近年来应用日益广泛。
(六)胰腺癌根治术的淋巴结清扫范围

对于胰腺癌淋巴结命名,目前国内外文献及指南多以日本胰腺协会的分组为命名标准。
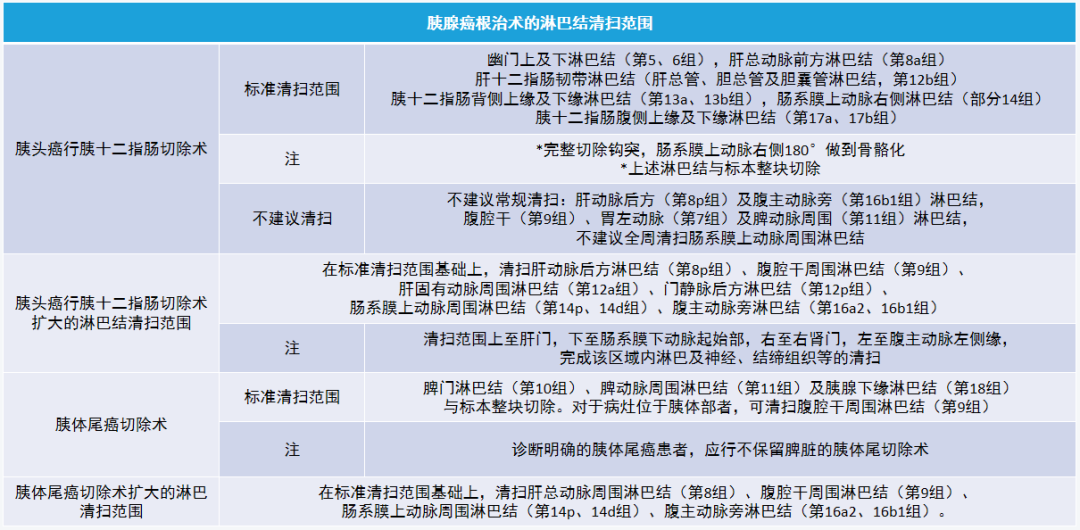
*Meta 分析示:扩大清扫组患者手术时间及术中出血量显著高于标准范围手术组,两组患者围手术期死亡率和总体生存期均无差异
回顾性单臂研究示:在全身系统治疗模式下,术中清扫以腹腔干、肠系膜上动脉及门静脉为边缘的三角形范围内的神经结缔组织有助于改善局部进展期患者预后,需高级别证据验证。
除临床研究之外,目前仍建议行标准范围的淋巴结清扫。
虽淋巴结清扫数量、阳性淋巴结和总淋巴结数比值与预后的相关性存在争议,但送检标本内一定数量的淋巴结有助于进行准确的 N 分期,并指导后续辅助治疗。提倡外科与病理科联合标准化处理手术标本,应获取 15 枚以上的淋巴结。
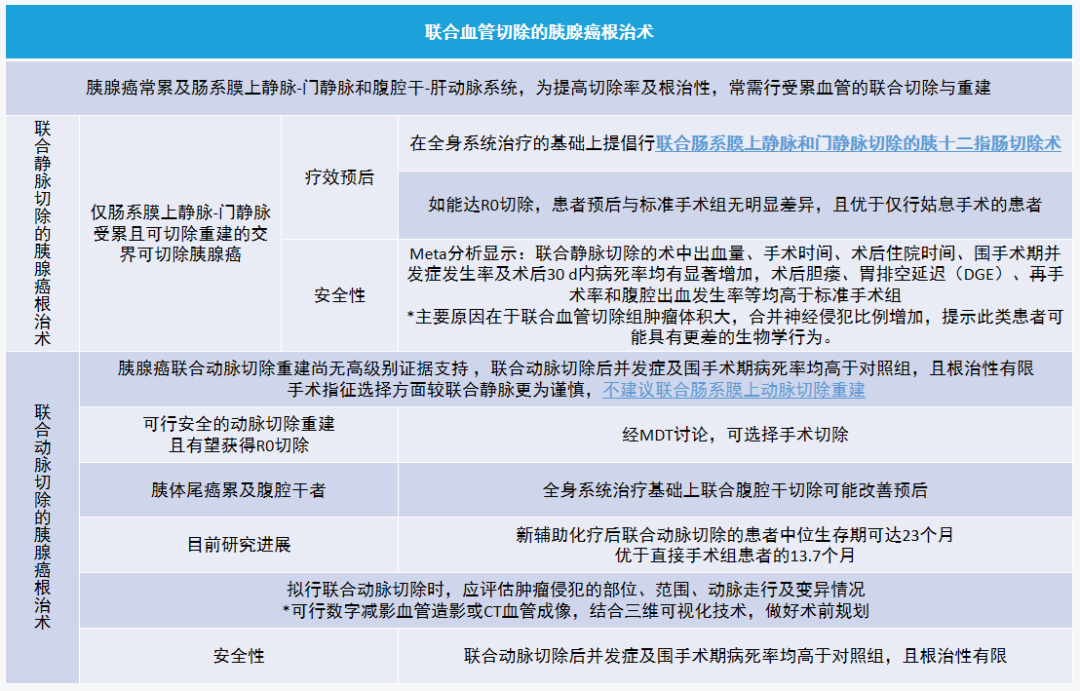
(七)联合血管切除的胰腺癌根治术

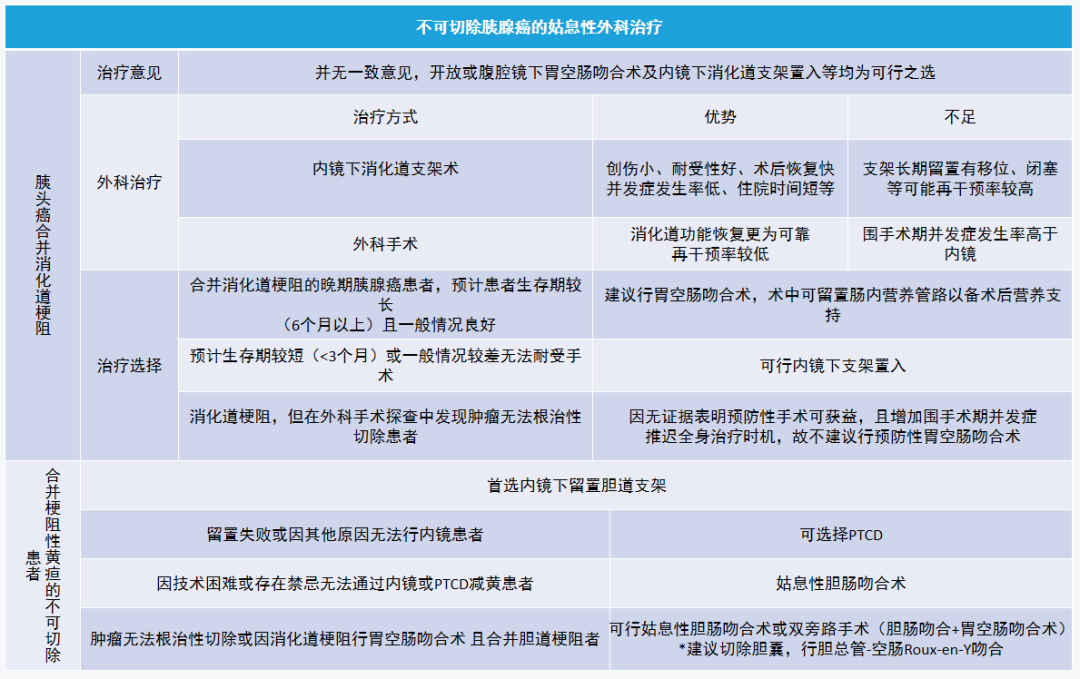
(八)不可切除胰腺癌的姑息性外科治疗

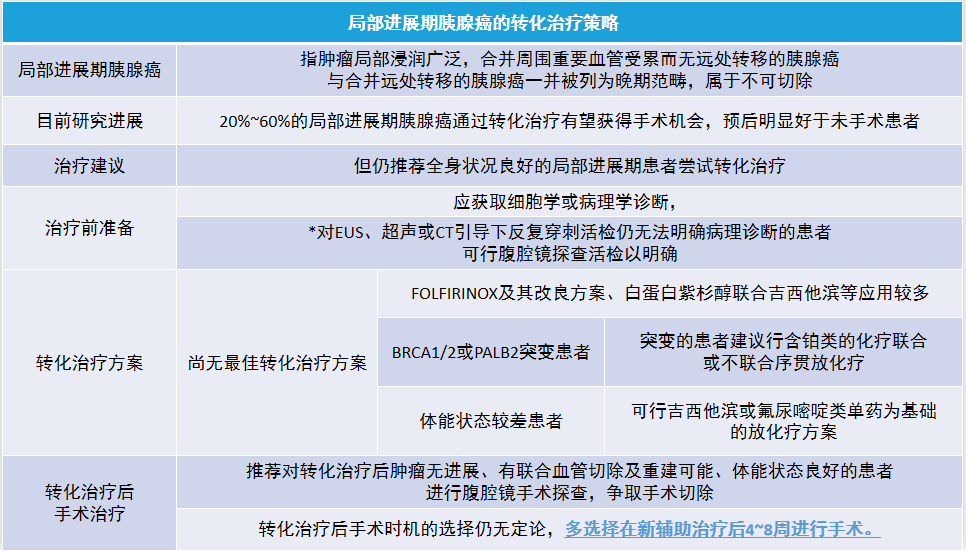
五、局部进展期胰腺癌的转化治疗策略

六、胰腺癌合并寡转移的治疗策略


七、胰腺癌患者术后管理的若干热点问题
(一)胰腺癌术中营养管路放置及术后营养支持策略



(二)胰腺癌术后生长抑素及其类似物的应用

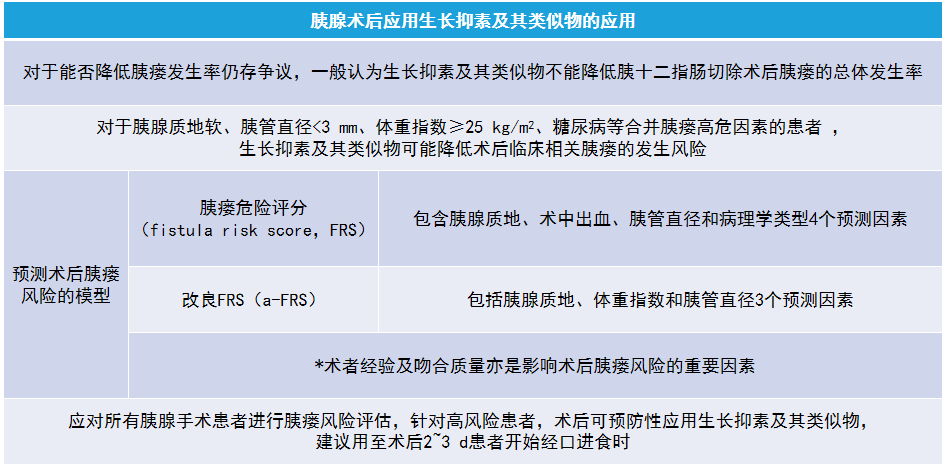
(三)胰腺癌术后腹腔引流管的管理


八、胰腺癌术后辅助治疗


九、胰腺癌手术标本的标准化检测及切缘状态评估

在保障标本完整性的前提下,提倡由外科及病理科医师合作完成胰十二指肠切除标本的标准化检测:
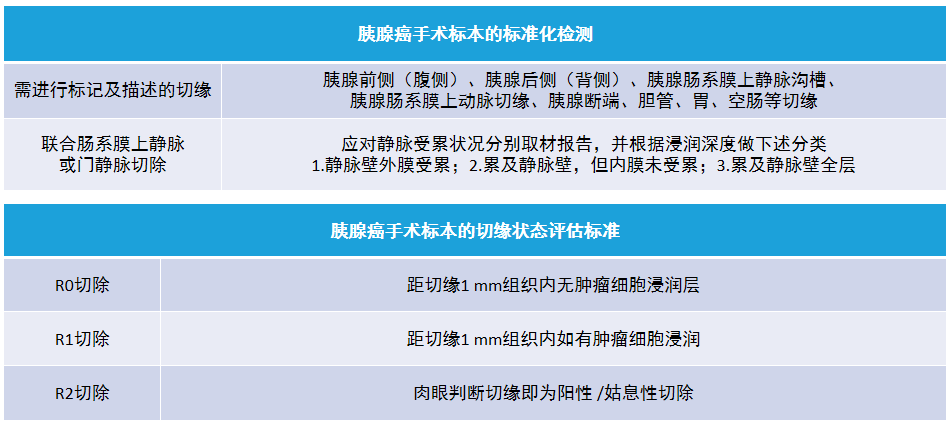
外科手术的目的是 R0 切除,但由于胰腺的解剖特点及肿瘤的生物学行为,难以避免以 R1 切除为手术结果,但仍可改善患者预后。文献报告与仅行姑息性短路手术的患者比较,R2 切除未能改善患者预后与生活质量,应予避免。
十、不可切除胰腺癌的化疗、靶向治疗与免疫治疗

局部进展期或转移性胰腺癌的综合治疗方案多有不确定性,提倡开展并参与相关临床研究。积极化疗有助于缓解症状、改善生活质量并延长生存期。
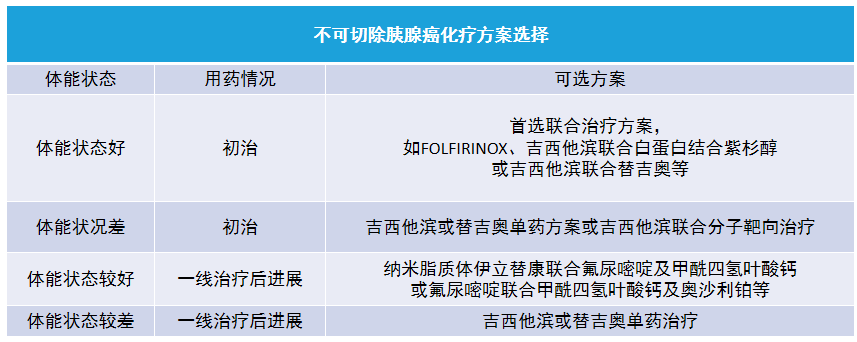
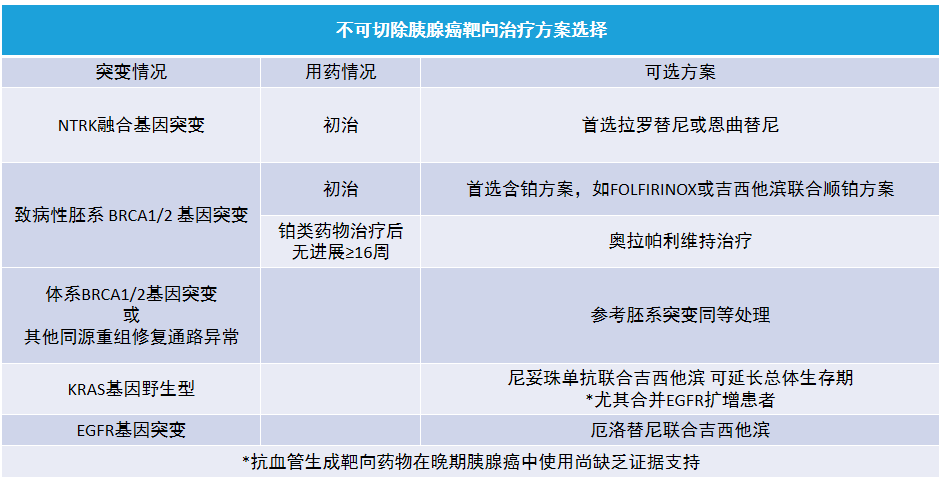

射频消融、冷冻、高能聚焦超声、伽马刀、放射性粒子植入等其他治疗尚无明确证据显示其能够延长患者生存期。
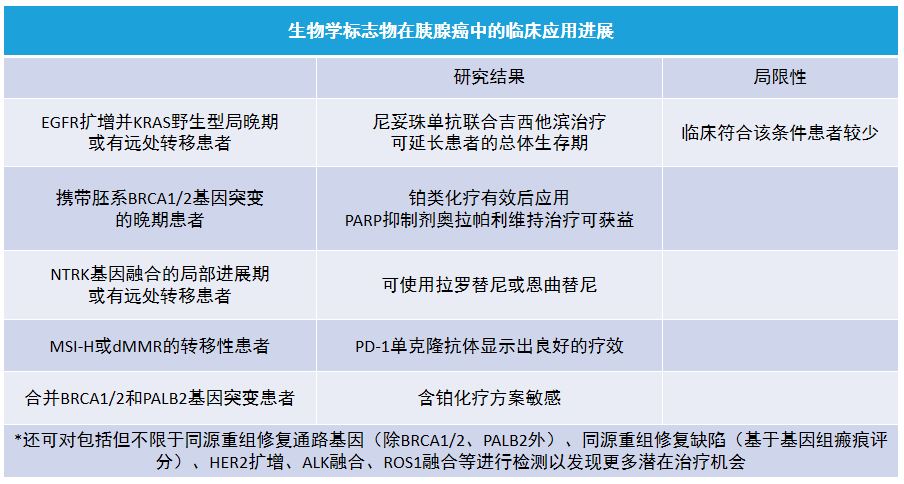
十一、基因学检测在胰腺癌诊治中的应用及其临床意义

近年来,基因学分子学检测技术的进步在胰腺癌发病机制、分子分型和药效等方面的研究中发挥了重要作用。然而,由于胰腺癌分子分型的复杂性及肿瘤的异质性,多数变异信息的生物学特别是临床意义仍不明确;同时胰腺癌常见驱动基因如 KRAS、TP53、CDKN2A 和 SMAD4 等尚无有效的靶向药物,也限制了基因学检测在胰腺癌临床诊治中的应用。
基于生物学标志物的靶向治疗、免疫治疗在胰腺癌临床应用初现曙光。
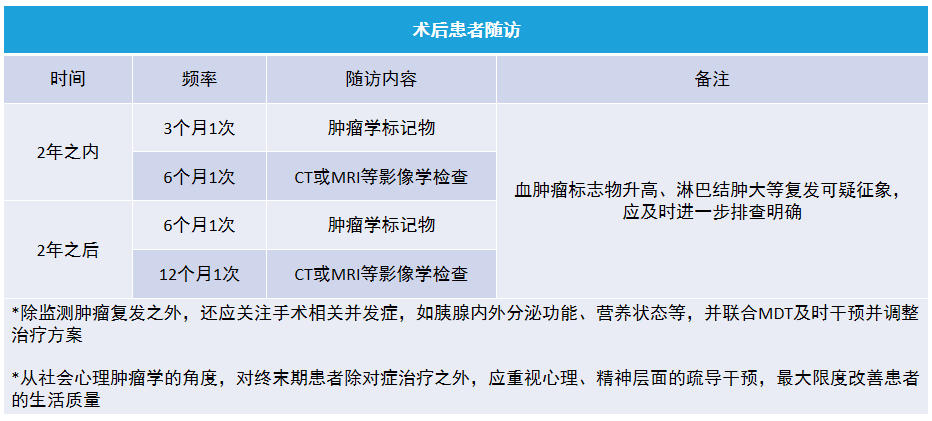
十二、胰腺癌术后患者随访

胰腺癌生物学行为恶性度极高,术后复发风险较高,部分患者术后早期即出现局部复发或远处转移。Groot 等回顾性分析了 957 例胰腺癌术后患者的临床资料,随访期间肿瘤复发率为 88.7%,其中 51.5% 的患者是在术后 1 年内出现局部复发或远处转移。国内大数据显示 2016—2019 年期间 3 279 例胰腺癌切除术后患者,9 个月内复发率为 45.87%。因此术后定期复查、密切随访极为重要。
* 本指南旨在为胰腺癌临床规范化诊治提供原则性指导,指南内容不可能涵盖所有临床现象,鉴于胰腺癌生物学行为的复杂性、患者之间的异质性、已有临床研究的局限性、治疗方案与治疗效果之间的不确定性等,临床实践中应据患者的具体情况,在本指南推荐意见指导下个体化选择具体治疗方案,最大限度改善患者预后。
✩ 本文仅供医疗卫生等专业人士参考
策划:GoEun,梅浙
投稿及合作:yinqihang@dxy.cn
题图来源:站酷海洛 PLUS
[1] 中华医学会外科学分会胰腺外科学组, 赵玉沛, 杨尹默, 等. 中国胰腺癌诊治指南 (2021)[J]. 中华外科杂志, 59(7):17.
