2018 年 6 月,世界卫生组织发布新版 「国际疾病分类 」(ICD-11),在消化系统疾病中共收录近 500 个疾病子项,是数量最为庞大的分类之一。
在药明奥测和 Mayo Clinic Laboratories 共同举办的「2019 新诊断国际高峰论坛」的学术分论坛上,消化系统疾病是与会者非常关注的焦点之一,来自国内知名医疗机构和 Mayo Clinic 的专家们就整合诊断理念下药物基因组学(PGx)技术指导炎症性肠病精准用药和常见肝病的临床检测痛点等话题进行了热烈的探讨。
01
PGx 可纳入常规诊疗并用于指导药物治疗
炎症性肠病是一类慢性特发性肠道疾病,包括克罗恩病和溃疡性结肠炎。以往这类疾病在欧美国家多发,又有「西方疾病」之称。近年来,炎症性肠病在亚洲地区的发病率呈现出日益走高的趋势。
目前炎症性肠病的治疗药物包括氨基水杨酸盐、糖皮质激素、免疫抑制剂和生物制剂等。这其中,硫唑嘌呤是炎症性肠病一线免疫抑制剂,也是维持治疗的主要 药物 [1]。
Mayo Clinic 个体化基因组学实验室主任 Ann M. Moyer 教授在演讲中提到,该药物易导致患者出现血液系统损害、感染、胃肠道反应、肝功能异常、头晕、乏力、关节痛和皮疹等不良反应。不良反应的严重程度与药物代谢酶基因的突变状态息息相关。

Ann M. Moyer 教授
图片来源:主办方提供
她以一位 33 岁的男性克罗恩病患者使用硫唑嘌呤的治疗经历,同与会者分享了如何利用 PGx 技术,在提高患者治疗获益的同时,降低硫唑嘌呤的不良反应风险。
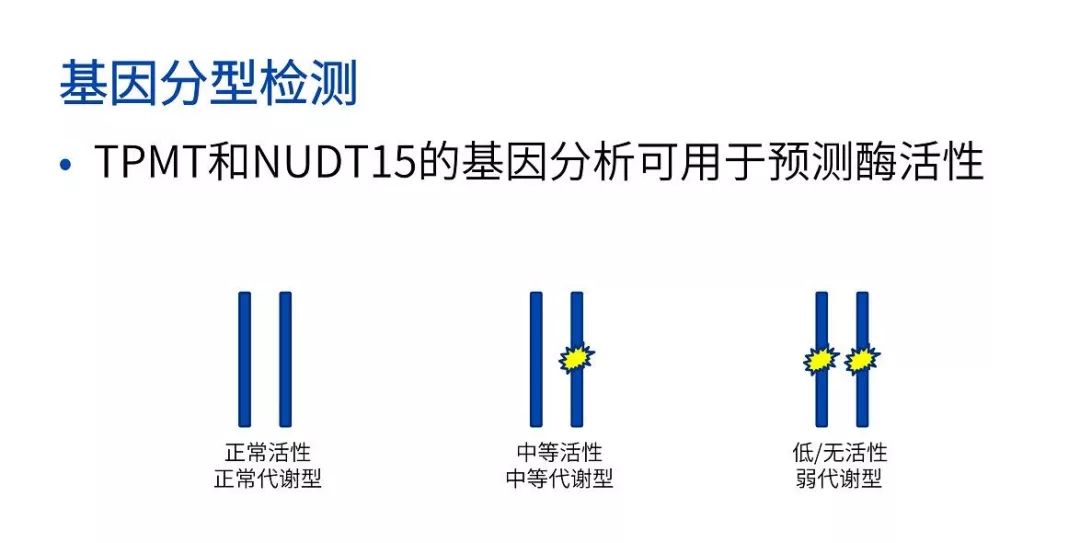
该患者因出现腹痛、血性腹泻、体重减轻和疲劳等症状而求医治疗,经临床和实验室检查,确诊为克罗恩病,并开始接受硫唑嘌呤的治疗。根据 FDA 的药物标签建议,在使用硫唑嘌呤治疗前,需要进行硫嘌呤甲基转移酶(TPMT)和核苷酸焦磷酸酶 15(NUDT15)基因的检测。
硫唑嘌呤本身并无治疗活性,是一种前体药物,它在体内首先转化为 6-巯基嘌呤(6-MP)。6-MP 在体内有 3 条代谢途径,其中两条途径的代谢终产物也没有治疗作用,只有一条经由次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)等代谢酶参与的途径最终会生成具有治疗活性的 6-巯鸟嘌呤核苷酸(6-TGN)。
在这一系列复杂的代谢网络中,TPMT 和 NUDT15 基因的突变状态被认为与硫唑嘌呤的不良反应有密切关系。
图片来源:Ann M. Moyer教授分享报告
经过基因检测发现,该患者的 TPMT 的表型是正常代谢型,NUDT15 的表型是中间代谢型。根据这一结果,该患者服用巯基嘌呤有可能造成活性代谢物和毒性的累积。通过减少巯基嘌呤药物的初始剂量,以及根据骨髓抑制程度调整后续剂量,可降低该患者的巯基嘌呤相关毒性风险。
不过,该患者的治疗经历到这里并没有结束。几个月后,虽然他的克罗恩病得到了良好控制,但又出现了持续的胃灼热感,在抗酸剂和其他非处方药治疗无效后,医生考虑使用质子泵抑制剂奥美拉唑进行治疗,但是疗效依然欠佳。
经过进一步检查,确诊 该患者患有胃食管返流,适于奥美拉唑治疗。因此医生在与基因检测实验室沟通后,决定检测奥美拉唑代谢酶 CYP2C19,结果发现 该患者的 CYP2C19 基因表型属于超快代 谢型 [2]。
Moyer 教授介绍说,根据荷兰药物遗传学工作组的建议,对于 CYP2C19 超快代谢型来说,需警惕有效血药浓度偏低,如有必要,可使用 3 倍的药物剂量。为此,医生加大了奥美拉唑的剂量,该患者的胃灼热感很快得到明显缓解。
Moyer 教授总结道,通过 该患者的病例可看出,PGx 检测纳入常规诊疗对指导药物合理应用有重要意义,病理医生、实验室人员可协助临床医生选择合理的检测时间和检测项目。但在指导药物治疗时,不能孤立地依赖基因检测结果,而需结合临床表现综合判断给药剂量。
02
整合诊断助力解决肝病检测临床痛点
炎症性肠病的发病率不断增高的同时,脂肪肝、乙肝、肝癌等各种肝病造成的未满足医疗需求亦亟待解决。吉林大学第一医院转化医学研究院副院长牛俊奇教授将演讲内容的重点聚焦于「肝脏疾病的临床检测痛点及新型诊断模型」。
 牛俊奇教授
牛俊奇教授
图片来源:主办方提供
全球范围内,非酒精性脂肪性肝病 (NAFLD) 人群占 25%。已经成为世界范围内最常见的慢性肝脏 疾病 [3]。
牛教授表示,这也是美国肝癌的高危因素。照此趋势,随着中国卫生事业的发展,乙肝和丙肝分别通过计划免疫和药物治疗等多种方式得到良好控制后,非酒精性脂肪性肝病或将成为最为严峻的肝脏疾病。
而对肝脏造成较大伤害的非酒精性脂肪性肝炎,目前的金标准依然是有创的肝脏活检,因此人们试图通过生物标志物的方式,来检测疾病是否进展为脂肪性肝炎 [4]。
牛教授介绍说,近年,融合了基因组学、转录组学、蛋白质组、代谢组学等多组学整合诊断技术对促进生物标志物的临床转化起到了巨大的作用,科学家发现了一系列涵盖疾病发展不同阶段的生物标志物。不久的将来,人们有望借助标志物预测脂肪性肝炎的发生发展,这有助于应对非酒精性脂肪性肝炎带来的健康 威胁 [5]。
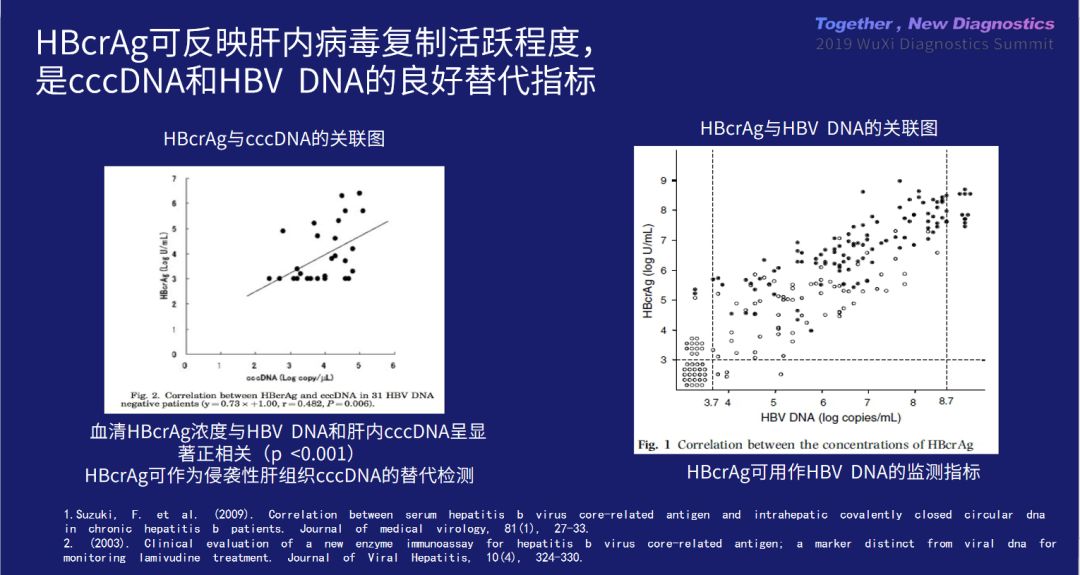
在乙肝领域,牛教授表示,相对于大部分丙肝可以实现临床治愈,乙肝的诊疗落后不少,「两对半」检查依然难以满足临床需求。根据目前的进展,乙肝核心相关抗原 HBCrAg [6]和乙肝病毒 RNA [7]是两种比较有希望的标志物。HBCrAg 是肝内 cccDNA 的良好替代指标,这一标志物的转化与应用一旦取得突破,可以帮助开发更具治疗潜力的新药。
图片来源:牛俊奇教授分享报告
乙肝病毒 RNA 的来源可能是核衣壳包裹的 pgRNA 在未启动逆转录步骤的情况下,直接获得包膜并以病毒样颗粒形式释放到血中。近年来,乙肝病毒 RNA 受到广泛关注,它能够较好地反映肝组织内 cccDNA 的活性,可作为衡量 cccDNA 水平和活性的替代标志物,有助于预测药物疗效及决定是否 换药 [8][9]。
提高肝癌的患者获益,早诊早治是关键。牛教授表示,血清甲胎蛋白 (AFP) 和肝脏超声检查是早期肝癌筛查的主要手段,但均有不足之处。很多研究者对 cfDNA、CTC 及蛋白标志物进行了深入探索,也取得了重要成果,但因尚缺乏大规模数据,技术转化较难且成本昂贵,不利于临床 使用 [10][11]。
他认为,为尽快扭转这一局面,除继续深入探索标志物相关的分子机制和转化研究外,可以利用整合诊断的思路,通过联合检测多个指标,结合先进的算法模型提高临床价值,譬如以性别、年龄和 3 个诊断常用的血清标志物 AFP、AFP-L3、DCP 整合构建而成的 GALAD 模型便在中国肝癌患者中表现出了优异的诊断效能。未来的整合诊断方法如能将多组学、大数据和全病程的方法加以融合,患者的临床获益必将有新的 突破 [12][13]。
整合诊断是精准医疗的基础和前提。在此次学术分论坛上,与会专家指出,高效率、高性价比的整合诊断将为推动消化疾病的诊疗乃至整个医疗行业的变革发挥重要作用。

参考文献:(上下滑动查看)
[1] 钱家鸣,杨红。中国炎症性肠病研究的历史回顾 现状和展望 [J]. 中国实用内科杂志,2015, 35 (9): 727-730.
[2] Pratt V M, Del Tredici A L, Hachad H, et al. Recommendations for clinical CYP2C19 genotyping allele selection: a report of the Association for Molecular Pathology[J]. The Journal of Molecular Diagnostics, 2018, 20(3): 269-276.
[3] Diehl A M, Day C. Cause, pathogenesis, and treatment of nonalcoholic steatohepatitis[J]. New England Journal of Medicine, 2017, 377(21): 2063-2072.
[4] Wong V W S, Adams L A, de Lédinghen V, et al. Noninvasive biomarkers in NAFLD and NASH—current progress and future promise[J]. Nature Reviews Gastroenterology & Hepatology, 2018, 15(8): 461-478.
[5] Pirola C J, Sookoian S. Multiomics biomarkers for the prediction of nonalcoholic fatty liver disease severity[J]. World journal of gastroenterology, 2018, 24(15): 1601.
[6] Suzuki F, Miyakoshi H, Kobayashi M, et al. Correlation between serum hepatitis B virus core‐related antigen and intrahepatic covalently closed circular DNA in chronic hepatitis B patients[J]. Journal of medical virology, 2009, 81(1): 27-33.
[7] Liu S, Zhou B, Valdes J D, et al. Serum hepatitis B virus RNA: a new potential biomarker for chronic hepatitis B virus infection[J]. Hepatology, 2019, 69(4): 1816-1827.
[8] van Bömmel F, Bartens A, Mysickova A, et al. Serum hepatitis B virus RNA levels as an early predictor of hepatitis B envelope antigen seroconversion during treatment with polymerase inhibitors[J]. Hepatology, 2015, 61(1): 66-76.
[9] Giersch K, Allweiss L, Volz T, et al. Serum HBV pgRNA as a clinical marker for cccDNA activity[J]. Journal of hepatology, 2017, 66(2): 460-462.
[10] Qu C, Wang Y, Wang P, et al. Detection of early-stage hepatocellular carcinoma in asymptomatic HBsAg-seropositive individuals by liquid biopsy[J]. Proceedings of the National Academy of Sciences, 2019, 116(13): 6308-6312.
[11] Gao Q, Zhu H, Dong L, et al. Integrated Proteogenomic Characterization of HBV-Related Hepatocellular Carcinoma[J]. Cell, 2019, 179(2): 561-577. e22.
[12] Johnson P J, Pirrie S J, Cox T F, et al. The detection of hepatocellular carcinoma using a prospectively developed and validated model based on serological biomarkers[J]. Cancer Epidemiology and Prevention Biomarkers, 2014, 23(1): 144-153.
[13] 林清标,董菁,柯坤宇,et al. GALAD 模型在肝细胞癌患者中的诊断价值验证 [J]. 中华肝脏病杂志,2018, 26 (8):621-623.
