编者按:丙酚替诺福韦(TAF)是当前欧洲肝脏研究学会(EASL)[1] 和美国肝病研究学会(AASLD)指南 [2] 推荐用于治疗慢性乙型肝炎(慢乙肝)的一线口服核苷(酸)类似物(NA),在火热召开的 AASLD2018 年会上,TAF 对比 TDF 治疗 III 期研究 144 周的疗效、安全性和耐药数据公布 [3,4],大家速来更新自己的知识库吧。
研究设计及方法简介
1298 例慢乙肝患者(873 例 HBeAg 阳性,110 研究;425 例 HBeAg 阴性,108 研究)按 2∶1 的比例随机分组,分别接受 TAF(25 mg,QD)或 TDF(300 mg,QD)治疗。治疗 96 周后,根据方案修正,50% 的入组患者继续双盲治疗 1 年,其余患者进入开放标签阶段,接受开放标签的 TAF 继续治疗。根据已公开的 48 周 [5,6] 和 96 周 [7,8] 数据,TAF 具有不劣于 TDF 的抗病毒活性和明显更优的肾脏骨骼安全性特征。
AASLD2018 上,中国香港中文大学陈力元教授报告的是 TAF 和 TDF 治疗 3 年的疗效和安全性比较(摘要号 381)[3]。共 1118 例患者被纳入分析(HBeAg 阳性患者 759 例,HBeAg 阴性患者 359 例),TAF 治疗者 866 例(包括双盲和开放标签阶段),TDF 治疗者 252 例(包括双盲治疗 3 年,提前停药,以及在 96 周时未进入 TAF 开放标签治疗的患者)。
不同组别和不同研究的患者基线特征相似(汇集数据):平均年龄 40 岁,63% 为男性,78% 为亚裔,大部分为基因 C、D 型(各为 48% 和 26%),平均 HBV DNA 为 7.0 log IU/mL(34% 的患者 HBV DNA 在 8 log 以上),25% 曾经接受过 NA 治疗。
治疗 144 周,TAF 与 TDF 维持相似的高病毒学抑制率,ALT 复常率更高
治疗 144 周时,各项研究中的 TAF 治疗与 TDF 治疗均维持相似的高病毒学控制率(HBV DNA<29 IU/mL),HBeAg 阴性人群的病毒学应答率为 87%(TAF)和 85%(TDF),P = 0.71;HBeAg 阳性人群的病毒学应答率为 74%(TAF)和 71%(TDF),P = 0.59,如图 1。
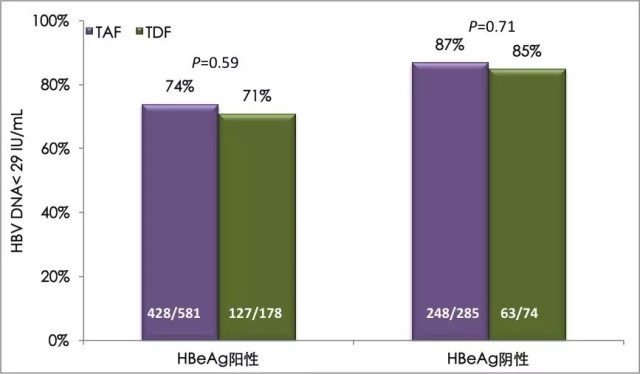
图 1 丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝 III 期研究 144 周的病毒学应答
TAF 治疗的患者的血清 ALT 复常率(男性 ≤ 35 U/L,女性 ≤ 25 U/L)更高(图 2),为 71%(HBeAg 阴性)和 64%(HBeAg 阳性),TDF 组为 59%(HBeAg 阴性)和 53%(HBeAg 阳性),P 值为 0.052(HBeAg 阴性人群)和 0.01(HBeAg 阳性人群)。按照中心实验室标准,TAF 组的 ALT 复常率也显著高于 TDF 组。
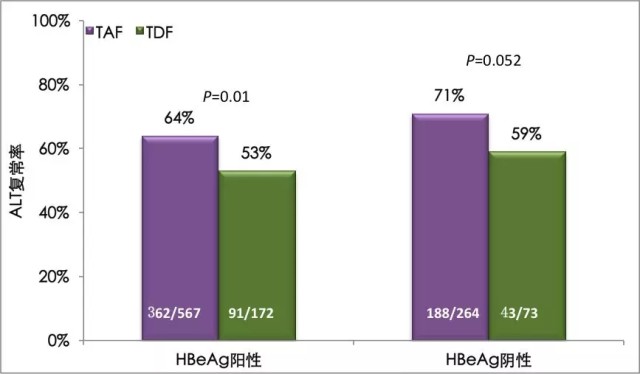
图 2 丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝 III 期研究 144 周的生化学应答
HBeAg 阳性患者中,两个治疗方案组的血清学应答率相似,分别有 24%(TAF 组)和 22%(TDF 组)的患者在治疗 3 年后 HBeAg 消失。
接受 TAF 治疗的患者中分别有 1 例 HBeAg 阴性患者和 8 例 HBeAg 阳性患者取得 HBsAg 消失,比例为 0.4% 和 1.4%,接受 TDF 治疗的患者中有 3 例 HBeAg 阳性患者取得 HBsAg 消失,比例为 1.7%。
治疗 144 周,TAF 与 TDF 整体安全性相似,但 TAF 组的肾脏和骨骼安全性持续改善
整体上,TAF 和 TDF 安全耐受性好。两组的不良事件(AE)和严重 AE 相似,因不良事件停药率低。
治疗 3 年,与 TDF 组相比,TAF 组的 eGFRCG 的下降更少(图 3),更低比例的患者 CKD 分级加重,更多患者表现为 CKD 分级改善,并且近端小管蛋白尿标志物变化更小。
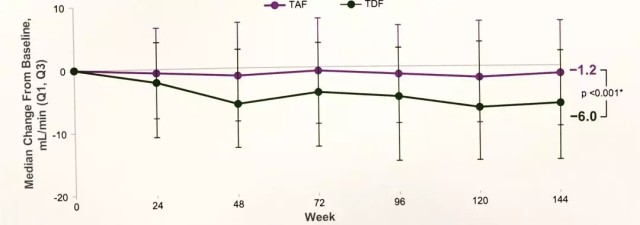
图 3 丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝 III 期研究 144 周的 eGFR 变化
治疗 3 年,髋关节和脊柱 BMD 的下降百分比均值在 TDF 治疗的患者中明显高于 TAF 治疗的患者(图 4)。BMD 下降的患者比例在 TAF 组更低,骨转换标志物在 TAF 组显示下降或仅有轻微增加。
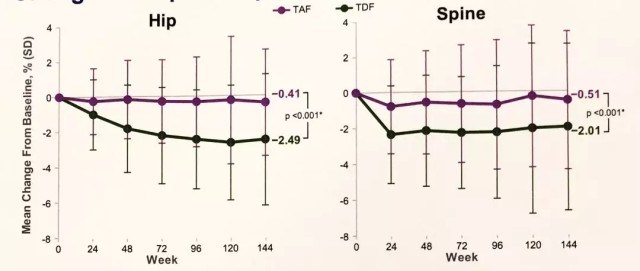
图 4 丙酚替诺福韦对比替诺福韦二吡呋酯治疗慢乙肝 III 期研究 144 周的骨密度变化
TAF 治疗慢性乙肝患者 144 周零耐药
TAF 全球 III 期试验中,使用 TAF 治疗 96 周未检出与 TAF 或 TDF 耐药有关的位点置换,即未出现耐药 [9]。本次会议上,陈力元教授报告(摘要号 386)[4],TAF 治疗 144 周,仍没有检测到与 TAF 耐药有关的变异,即 TAF 治疗 144 周保持「零」耐药(下列结果参考自 AASLD2018 现场展出壁报)。
该研究针对的是 TAF 对比 TDF 全球 III 期试验的队列,对于治疗 24 周及以上、在 144 周时或提前停药时 HBV DNA 仍 ≥ 69 IU/mL 的所有患者,使用 Illumina Mi-Seq 深度测序法对 HBV 基因的 pol/RT 区测序,报告一致性序列水平变化 15% 以上的序列改变。病毒学突破(VB)定义为获得 HBV DNA<69 IU/mL 之后 2 次检测 HBV DNA ≥ 69 IU/mL 或 HBV DNA 水平较最低水平升高 1.0 log 或以上。对于依从试验药物(通过血浆 TFV 浓度判定)的 VB 患者、出现保守位点置换的患者或见于>1 名患者的多态位点置换,进行体外表型分析。
9.9% 的入组患者在末次访视时符合测序标准,其中 TAF 治疗人群(双盲和开放标签阶段)10.4%,TDF 治疗人群(双盲)7.5%。所有这 128 例患者的测序结果显示,63 例无序列改变,22 例由于病毒载量过低而无法测序,31 例有多态位点置换,12 例有保守位点置换,保守位点的改变都不重复。
144 周时,3.5%(46/1298)的患者出现了 VB(其中 57% 证实为不依从)。这些患者的测序结果提示,他们的序列改变类型分布与整体队列相似。另外,经治和初治患者的序列改变类型分布也是相似的。
23 例无法确定不依从试验方案的 VB 患者接受了表型分析,结果显示其对试验药物均敏感。对所有 49 例符合标准的患者的表型分析均未检测到 TAF 或 TDF(TFV)表型耐药。这说明两个药物治疗 144 周未产生耐药。
结语和讨论
TAF 的体外血浆半衰期达 90 min,显著长于 TDF 的 0.4 min,在血浆中更稳定。TAF 能直接靶向递送至肝脏,使得在较低剂量时即可达到相似的抗病毒活性、TFV 的全身暴露减少,因此肾脏和骨骼毒性下降 [2]。1b 期研究发现,≤ 25 mg 的 TAF 能达到与 300 mg 的 TDF 相似的病毒抑制,但 TFV 的暴露减少 90% 以上 [10]。对机制的进一步研究 [11] 显示,TAF 能通过多个步骤被肝细胞有效地摄取和活化,使肝细胞内维持高浓度的活性代谢产物替诺福韦双磷酸盐(TFV-DP)。在犬体内的药代动力学研究表明,肝脏能高效摄取 TAF,摄取率约 65%[12]。TAF 在肝脏中的高效摄取与肝细胞表达的阴离子转运多肽(OATP1B1 和 OATP1B3)有关,活化主要由羧酸酯酶 1 介导 [11]。
作为已经批准用于慢乙肝治疗的一线 NA,AASLD2018 上公布的 TAF 治疗 144 周的数据结论与前期结论保持一致,TAF 长期用药可维持高病毒学抑制,相比 TDF 有更高的 ALT 复常率,用药 144 周无耐药发生,同时患者肾脏和骨骼的安全性持续改善。这些数据的逐步完善,将有利于临床医生在长期抗病毒治疗过程中更好地「以患者为中心」,优化患者管理。
参考文献
[1] European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol (2017), http://dx.doi.org/10.1016/j.jhep.2017.03.021
[2] Terrault NA, Lok AS, McMahon BJ, et al. Update on Prevention, Diagnosis, and Treatment and of Chronic Hepatitis B: AASLD 2018 Hepatitis B Guidance. Hepatology. 2018, https://doi.org/10.1002/hep.29800
[3] Chan HL, Lim YS, Seto WK, et al. Three Year Efficacy and Safety of Tenofovir Alafenamide (TAF) Compared to Tenofovir Disoproxil Fumarate (TDF) in Hbeag-Negative and Hbeag-Positive Patients with Chronic Hepatitis B. AASLD2018 Poster 381.
[4] Chan HL, Marcellin P, Pan CQ, et al. No Resistance to Tenofovir Alafenamide Detected through 144 Weeks of Treatment in Patients with Chronic Hepatitis B. AASLD2018. Poster 386.
[5] Buti M, Gane Ed, Seto WK, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg-negative chronic hepatitis B virus infection: a randomised, double-blind,phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol. 2016; 1: 196–206.
[6] Chan HL, Fung, Seto WK, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of HBeAg-positive chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol. 2016; 1: 185–95
[7] Agarwal K, Fung S, Seto WK, et al. A phase 3 study comparing tenofovir alafenamide (TAF) to tenofovir disoproxil fumarate (TDF) in patients with HBeAg-positive, chronic hepatitis B: efficacy and safety results at week 96 Journal of Hepatology 2017;66 (suppl 1):S478. FIR-153
[8] Brunetto M, Lim YS, Gane E, Seto WK, Osipenko M, Ahn SH, Janssen HS, et al. A Phase 3 Study Comparing Tenofovir Alafenamide (TAF) to Tenofovir Disoproxil Fumarate (TDF) in Patients With HBeAg-Negative, Chronic Hepatitis B (CHB): Efficacy and Safety Results at Week 96. Journal of Hepatology 2017;152 (suppl 1):S25. PS-042
[9] Cathcart AL, Chan HL, Bhardwaj N, et al. No Resistance to Tenofovir Alafenamide Detected through 96 Weeks of Treatment in Patients with Chronic Hepatitis B Infection. Antimicrob Agents Chemother. 2018 Sep 24;62(10). pii: e01064-18.
[10] Agarwal K, Fung SK, Nguyen TT, et al. Twenty-eight day safety, antiviral activity, and pharmacokinetics of tenofovir alafenamide for treatment of chronic hepatitis B infection. J Hepatol 2014;62:533–540. .
[11] Murakami E, Wang T, Park YJ, et al. Implications of Efficient Hepatic Delivery by Tenofovir Alafenamide (GS-7340) for Hepatitis B Virus Therapy. Antimicrob Agents Chemoth. 2015;59(6):3563-3569
[12] Babusis D, Phan TK, Lee WA, et al. Mechanism for effective lymphoid cell and tissue loading following oral administration of nucleotide prodrug GS-7340. Mol Pharm 2013. 10:459–466.
封面图来源于|CORPORATE
